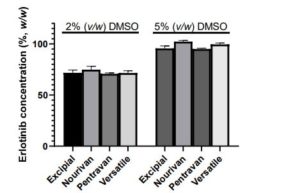
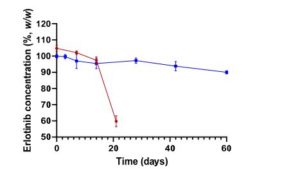
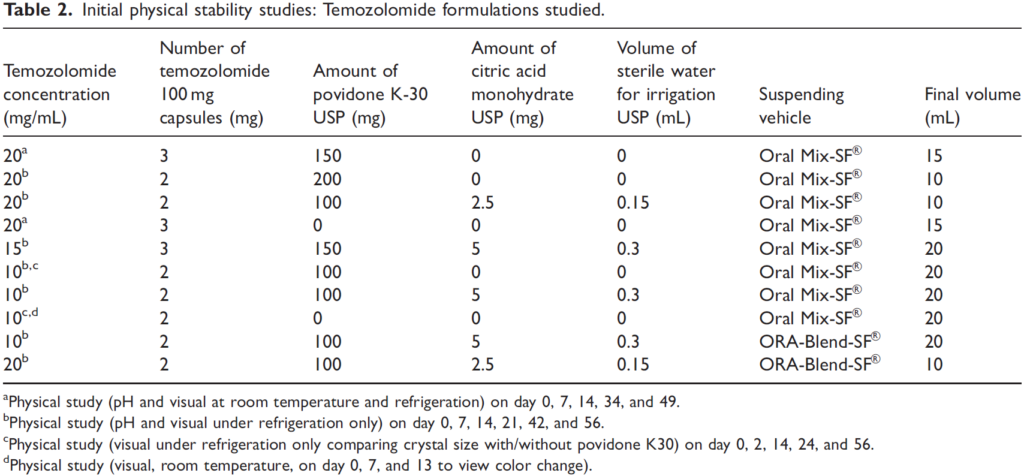
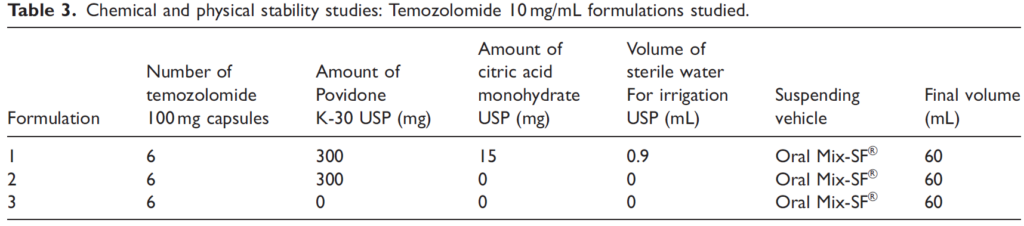
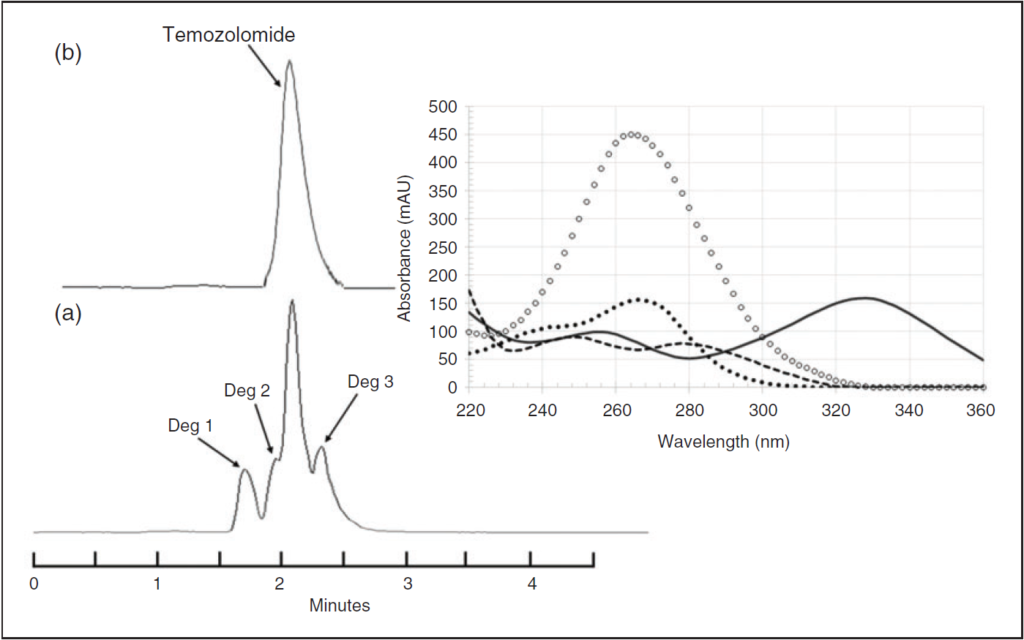
-
PHARmaciens Acteurs en Oncologie – PHARAON
Ce calculateur est le fruit d’un travail réalisé par un groupe de pharmaciens spécialisés en Oncologie. La SFPO apporte son soutien technique et scientifique pour accéder au simulateur et aux données compilées ; la propriété intellectuelle de ce calculateur appartient aux auteurs : R. Chevrier (Clermont-Ferrand – Centre Jean Perrin), F. Correard (Marseille – AP-HM), F. De Crozals (Avignon – Institut Sainte-Catherine), B. Favier (Lyon – Centre Léon Bérard), F. Leenhardt (Montpellier – Institut de cancérologie), B. Lortal (Bordeaux – Institut Bergonie), S. Perriat (Toulouse – Oncopole), S. Rochard (médical Pfizer), A. Schmitt (Dijon – CGFL), W. Azouza (Mougins – Hôpital Privé Arnault Tzanck), I. Vincent (Bordeaux – PBNA), H. Bertucat (Vichy – Centre Hospitalier).
À lire avant d’utiliser l’outil
Objectif de l’outil
L’évolution des pratiques pharmaceutiques impose une refonte des organisations et nécessite de mobiliser des ressources. A ce titre, des pharmaciens et des membres du laboratoire Pfizer se sont rassemblés autour d’un groupe de réflexion, le groupe PHARAON, afin de s’interroger sur les modes de valorisation de la pharmacie clinique oncologique. Le groupe a conçu cet outil permettant à chacun d’évaluer les effectifs à mobiliser, le volume d’activité attendu (en nombre de patients ou de séances), ou encore le résultat financier qu’il peut espérer atteindre dans le cadre d’un projet de pharmacie clinique oncologique.
Préambule
Avant de compléter cette grille, une lecture attentive de la circulaire Gradation des soins du 10/09/2020 est conseillée.
Elle doit vous permettre d’identifier les acteurs et/ou les interventions entrant dans le champ de la facturation des Hôpitaux De Jour (HDJ) et le cadre de prise en charge de ces consultations de suivi (Intervention Ambulatoire Coordonnée -ou IAC-, Primo Prescription de Chimiothérapie Orale -ou PPCO-, ou consultations non facturables ou non facturées).
Si le suivi est assuré sur le mode d’Intervention Ambulatoire Coordonnée (IAC), la question du nombre d’intervenant et/ou d’intervention devra se poser à nouveau ainsi que la fréquence de suivi : -
Mode d’emploi
L’outil a été développé pour s’adapter de façon spécifique à chaque PUI. L’utilisateur a accès à trois onglets :
• L’onglet “Paramétrage”, propose des valeurs par défaut. Il vous faut modifier ces données pour les faire correspondre à celles de votre structure pour que les calculs réalisés soient bien le reflet de votre organisation (actuelle ou souhaitée) selon vos simulations.
• Les onglets « Consultation » et « ETP » (pour Education Théraeutique du patient) vous permettent de consulter les simulations calculées par l’outil en fonction des paramètres que vous aurez ajustés à votre cas.L’onglet « Paramétrage » :
A noter que l’outil prend en compte 3 types de consultations :
- Non valorisées (par exemple téléconsultations)
- Valorisées dans le cadre du MIG « Primo-Prescription de Chimiothérapie Orale » (PPCO)
- Valorisées dans le cadre d’une Intervention Ambulatoire Coordonnée (IAC)
Dans cet onglet sont d’abord renseignées les différentes données utilisées pour faire fonctionner l’outil en adéquation avec les pratiques et données propres à chaque structure. Afin d’obtenir les files actives de patients sous thérapies orales exclusives (pas de traitement injectable associé) éligibles aux PPCO et/ou IAC, les frais de structure, et autres éléments que vous ne connaissez pas, rapprochez-vous de votre DIM ou DAF, ils vous aideront à compléter les paramétrages requis pour une estimation au plus juste correspondant à votre établissement hospitalier.
NB : La colonne « Commentaires et sources » comporte une proposition saisie par défaut qui correspond à une valeur issue de la littérature, de l’expérience, ou d’établissements sondés. Ces valeurs peuvent vous servir de référence si besoin, mais n’ont aucune valeur officielle.
L’utilisateur doit donc commencer par modifier chaque donnée ne correspondant pas à sa situation et son organisation dans les cases « Valeur retenue » en l’adaptant à son cas spécifique.A noter que les calculs dans ces onglets sont basés sur une organisation optimale :
S’il est indiqué qu’1 Équivalent Temps Plein (ETP) est disponible pour une activité, l’outil considère que chaque instant de cet ETP est consacré à l’activité en question, en tenir compte dans vos paramétrages.Les onglets « Consultations » :
Ces onglets vous donnent le résultat de vos simulations en fonction des paramètres que vous avez saisis et des hypothèses que vous y soumettez.
Chaque onglet correspond à une donnée d’entrée différente :
Selon la donnée dont il dispose et/ou la structure de son projet, l’utilisateur remplit les cases blanches de l’onglet correspondant, l’outil génère alors les autres données dans les cases grises.- à partir de l’effectif disponible ou désiré, exprimé en Équivalent Temps Plein (ETP): onglet Consultations par ETP
Dans cet onglet, vous renseignez un nombre d’Équivalent Temps Plein de pharmaciens et vous obtiendrez le chiffre d’affaire généré par la quotité de temps pharmacien au regard des paramètres renseignés dans l’onglet « Paramétrage » (répartition par type de salaire notamment) - à partir du nombre de patients vus ou à voir en consultation : onglet Consultations par nombre de patients
Dans cet onglet, vous renseignez la file active à suivre et vous obtiendrez le chiffre d’affaire généré et le temps pharmacien nécessaire pour prendre en charge cette file active au regard des paramètres renseignés dans l’onglet « Paramétrage » - à partir du budget alloué à l’activité : onglet Consultations par budget
Dans cet onglet, vous renseignez un chiffre d’affaire souhaité dégagé par la pharmacie et vous obtiendrez le nombre de patients possibles à suivre ainsi que le nombre d’Équivalent Temps Plein à affecter à cette activité au regard des paramètres renseignés dans l’onglet « Paramétrage »
Les onglets « Education Thérapeutique du Patient (ETP) » :
Cet onglet se concentre sur l’activité d’Éducation Thérapeutique du Patient (ETP).
La logique concernant les Équivalents Temps Plein, le nombre de patients ou le budget sont identiques aux onglets précédents, mais les 3 possibilités sont regroupées sur un seul tableau.
Attention ! Les renseignements donnés par cet onglet concernent des sessions uniquement réalisées par les pharmaciens.
Dissocier le Chiffre d’Affaires (CA) généré par la pharmacie isolé du reste des intervenants, si c’est le cas, semble très compliqué pour l’ETP, il faut alors prendre en compte le nombre d’intervenants et le temps de chacun sur les séances. -
Sauvegarde de votre configuration pour pouvoir charger vos données ultérieurement :
Vous devez être connecté pour sauvegarder / charger vos configurations.
-
Charger une configuration pour pouvoir charger vos données ultérieurement :
Vous devez être connecté pour sauvegarder / charger vos configurations.
revoyez vos paramètres.